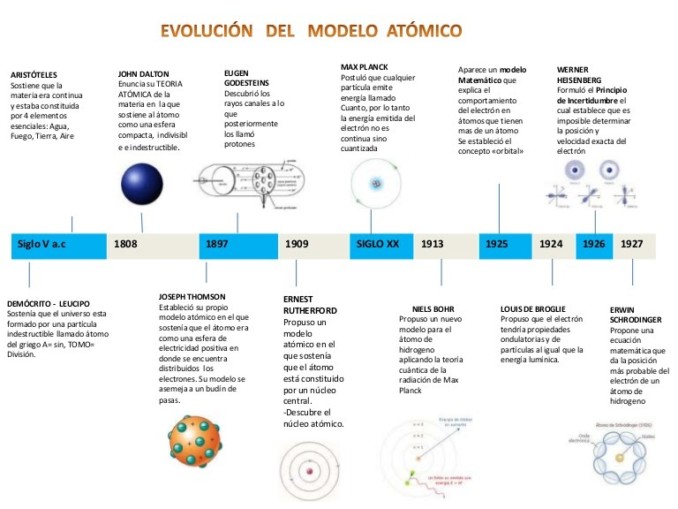
Modelo atomico de Dalton
El modelo atómico de Dalton surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, pro
puesto entre 1803 y 1807 por John Dalton aunque el autor lo denominó más propiamente "teoría atómica" o "postulados atómicos". El modelo permitió aclarar por primera vez el por qué las sustancias químicas reaccionaban en proporciones estequiométricasfijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples). Por ejemplo 12 g de carbono (C), pueden reaccionar con 16 g de oxígeno (O2) para formar monóxido de carbono (CO) o pueden reaccionar con 32 g de oxígeno para formar dióxido de carbono (CO2). Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos. En esencia, el modelo explicaba la mayor parte de la química de fines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
puesto entre 1803 y 1807 por John Dalton aunque el autor lo denominó más propiamente "teoría atómica" o "postulados atómicos". El modelo permitió aclarar por primera vez el por qué las sustancias químicas reaccionaban en proporciones estequiométricasfijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples). Por ejemplo 12 g de carbono (C), pueden reaccionar con 16 g de oxígeno (O2) para formar monóxido de carbono (CO) o pueden reaccionar con 32 g de oxígeno para formar dióxido de carbono (CO2). Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos. En esencia, el modelo explicaba la mayor parte de la química de fines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
Modelo de Thomson
El modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Thomson, quien descubrió el electrón en 1897, pocos años antes del descubrimiento del protón y del neutrón. En el modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, incrusta
dos en este al igual que las pasas de un pudin. Por esta comparación, fue que el supuesto se denominó «Modelo del pudin de pasas». Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
Modelo de nagaoka
Estudió en Alemania y Austria entre 1893 y 1896. En 1904 desarrolló un temprano, e incorrecto, "modelo planetario" del átomo (teoría saturniana) que proponía una gran esfera cargada positivamente y rodeada por los electrones, que la orbitaban. Posteriormente investigó en el campo de la espectroscopia. Presidió la Universidad de Osakaentre 1931 y 1934. Los físicos alrededor la primera década del siglo veinte acababan de asomarse a la estructura del átomo. El reciente descubrimiento de J. J. Thomson sobre los electrones cargados negativamente (1897) implicaba que un átomo neutro también debía contener una parte positivamente cargada. En 1903 Thomson sugirió que el átomo era una esfera de carga eléctrica uniformemente positiva, con electrones esparcidos en su interior como lo estarían las ciruelas en el interior de un pudding de ciruelas, uno de los nombres coloquiales dado al modelo atómico de Thomson. Nagaoka rechazó el modelo de Thomson, debido a que las cargas opuestas son impenetrables por la carga opuesta. Debido a su disconformaidad propuso un modelo alternativo en el que un centro de carga positiva estaba rodeado por un número de electrones que giran, haciendo el símil con Saturno y sus anillos. En 1904, Nagaoka desarrollo uno de los primeros modelos planetarios del átomo. Tales como el Modelo atómico de Rutherford. El Modelo de Nagaoka estaba basado alrededor de la analogía con Saturno (planeta) y con las teorías que explicaban la estabilidad y relaciones gravitatorias entre este y sus anillos.
Modelo de Rutherford
Para Ernest Rutherford, el átomo era un sistema planetario de electrones girando alrededor de un núcleo atómico pesado y con carga eléctrica positiva. El módelo atómico de Rutherford puede resumirse de la siguiente manera: El átomo posee un núcleo central pequeño, con carga eléctrica positiva, que contiene casi toda la masa del átomo. Los electrones giran a grandes distancias alrededor del núcleo en órbitas circulares. La suma de las cargas eléctricas negativas de los electrones debe ser igual a la carg
a positiva del núcleo, ya que el átomo es eléctricamente neutro. Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m). El hecho de que el núcleo tenga un diámetro unas diez mil veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
Átomo de Bohr
La característica esencial del modelo de Bohr es que, según él, los electrones se ubican alrededor del núcleo únicamente a ciertas distancias bien determinadas. El porqué de esta disposición se estableció más tarde, cuando el desarrollo de la mecánica cuántica alcanzó su plena madurez.
El modelo de Bohr es muy simple y recuerda al modelo planetario de Copérnico, los planetas describiendo órbitas circulares alrededor del Sol.
El electrón de un átomo describe también órbitas circulares, pero los radios de estas órbitas no pueden tener cualquier valor, sino valores fijos.
Cuando un electrón salta de una órbita a otra, lo hace sin pasar por órbitas intermedias. Esto es una afirmación que rompe las ideas normales que tenemos, porque no podemos visualizar cómo sucede esto exactamente.
Es pertinente recordar lo que dijo Einstein: "... debemos admirar humildemente la bella armonía de la estructura de este mundo, en la medida en que podamos comprenderlo. Eso es todo."
Consideremos un átomo con un solo electrón, en el que hay:
a) un núcleo de carga eléctrica Z suficientemente pesado para considerarlo inmóvil.
b) un electrón que describe una órbita circular de radio r.
En el modelo de Bohr, se estipula que la energía del electrón es mayor cuanto mayor sea el radio r.
Por lo cual, cuando el electrón salta a una órbita de menor radio, se pierde energía. Esa energía perdida es la que el átomo emite hacia el exterior en forma de un quanto de luz. Dicho de otro modo, en forma de fotón.
Modelo atómico de Sommerfeld
El físico alemán Arnold Sommerfeld, crea en 1916, el modelo atómico que lleva su nombre, para dar algunas mejoras al modelo atómico de Bohr, ayudándose de la relatividad de Albert Einstein, teoría que había conocido al entrar como profesor en la Universidad de Munich, cuando aun la teoría de la relatividad no estaba aceptada. Sommerfeld, es más conocido en el mundo científico por su aportación a la ciencia con la constante de la estructura fina en 1919, que es la constante física fundamental en la interacción electromagnética.
El modelo atómico de Bohr, tenía algunas insuficiencias, ya que aunque funcionaba perfectamente para el átomo de hidrógeno, no funcionaba de igual manera para dar explicación a los espectros realizados para otros átomos de otros elementos, donde se veía claramente que los electrones de un mismo nivel energético poseían diferentes energías. Lo cual hacía evidente, que algo faltaba en ese modelo.
Sommerfeld, llegó a la conclusión, de que este comportamiento de los electrones se podía explicar, diciendo que dentro de un mismo nivel de energía existían distintos subniveles energéticos, lo que hacía que hubiesen diversas variaciones de energía, dentro de un mismo nivel teóricamente, Sommerfeld había encontrado que en algunos átomos, las velocidades que experimentaban los electrones llegaban a ser cercanas a la de la luz, así que se dedicó a estudiar los electrones como relativistas.
Fue en 1916 cuando Sommerfeld perfeccionó el modelo atómico de Bohr, intentando solucionar los dos defectos principales de ese modelo. De este modo, hizo dos básicas modificaciones:
Los electrones describían órbitas cuasi- elípticas.
Velocidades relativistas.
Según Bohr, os electrones giraban exclusivamente en modo circular. Una orbita céntrica dio lugar a un nuevo número cuántico, que se denominaría como número cuántico Azimutal, que definiría la forma de los orbitales, y se representaría con la letra l, tomando valores variables desde 0 hasta n-1.
Así, las órbitas con:
l=0 serían los posteriormente conocidos como orbitales S.
l=1 se llamaría orbital 2p u orbital principal.
l=2 se conocería como d, u orbital diffuse.
L=3 sería el orbital llamado f o fundamental.
Sommerfeld defendió, que el núcleo de los átomos no es permanece quieto, sino que ya sea electrón o núcleo, ambos realizan un movimiento entorno al centro de masas del sistema, que se encontrará cercano al núcleo debido a que posee una masa miles de veces mayor que la masa del electrón. Esto hacía coincidir las frecuencias calculadas con las experimentadas.
Las líneas espectrales se desdoblaban y para explicar este punto, Sommerfeld, usando buenos espectroscopios, supuso que los electrones podían tener orbitas tanto elípticas como circulares. Añade el número cuántico secundario ( l) e indica en la orbita del electrón, el momento angular de éste como,  hallando los subniveles de energía para cada nivel cuántico.
hallando los subniveles de energía para cada nivel cuántico.
 hallando los subniveles de energía para cada nivel cuántico.
hallando los subniveles de energía para cada nivel cuántico.
El modelo atómico de Sommerfeld, es una adaptación mejorada y generalizada del modelo atómico de Bohr, dándole a éste, un punto de vista relativista, pero aun así, no pudo explicar los modos de emisión que tenían las órbitas elípticas, pudiendo sólo descartar las órbitas circulares.
Teoría de Schrödinger
El modelo atómico de Schrödinger (1924) es un modelo cuántico no relativista. Se basa en la solución de la ecuación de Schrödinger para un potencial electrostático con simetría esférica, llamado también átomo hidrogenoide. En este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico. El modelo de Bohr funcionaba muy bien para el átomo de hidrógeno. En los espectros realizados para otros átomos se observaba que electrones de un mismo nivel energético tenían energías ligeramente diferentes. Esto no tenía explicación en el modelo de Bohr, y sugería que se necesitaba alguna corrección. La propuesta fue que dentro de un mismo nivel energético existían subniveles. La forma concreta en que surgieron de manera natural estos subniveles, fue incorporando órbitas elípticas y correcciones relativistas. Así, en1916, Arnold Sommerfeld modificó el modelo atómico de Bohr, en el cual los electrones sólo giraban en órbitas circulares, al decir que también podían
girar en órbitas elípticas más complejas y calculó los efectos relativistas. El modelo atómico de Schrödinger concebía originalmente los electrones como ondas de materia. Así la ecuación se interpretaba como la ecuación ondulatoria que describía la evolución en el tiempo y el espacio de dicha onda material. Más tarde Max Born propuso una interpretación probabilística de la función de onda de los electrones. Esa nueva interpretación es compatible con los electrones concebidos como partículas casi puntuales cuya probabilidad de presencia en una determinada región viene dada por la integral del cuadrado de la función de onda en una región. Es decir, en la interpretación posterior del modelo, éste era modelo probabilista que permitía hacer predicciones empíricas, pero en el que la posición y la cantidad de movimiento pueden conocerse simultáneamente, por el principio de incertidumbre. Así mismo el resultado de ciertas mediciones no está determinadas por el modelo, sino sólo el conjunto de resultados posibles y su distribución de probabilidad.
girar en órbitas elípticas más complejas y calculó los efectos relativistas. El modelo atómico de Schrödinger concebía originalmente los electrones como ondas de materia. Así la ecuación se interpretaba como la ecuación ondulatoria que describía la evolución en el tiempo y el espacio de dicha onda material. Más tarde Max Born propuso una interpretación probabilística de la función de onda de los electrones. Esa nueva interpretación es compatible con los electrones concebidos como partículas casi puntuales cuya probabilidad de presencia en una determinada región viene dada por la integral del cuadrado de la función de onda en una región. Es decir, en la interpretación posterior del modelo, éste era modelo probabilista que permitía hacer predicciones empíricas, pero en el que la posición y la cantidad de movimiento pueden conocerse simultáneamente, por el principio de incertidumbre. Así mismo el resultado de ciertas mediciones no está determinadas por el modelo, sino sólo el conjunto de resultados posibles y su distribución de probabilidad.
Modelo atómico
El modelo atómico de Schrödinger predice adecuadamente las líneas de emisión espectrales, tanto de átomos neutros como de átomos ionizados. El modelo también predice adecuadamente la modificación de los niveles energéticos cuando existe un campo magnético o eléctrico (efecto Zeeman y efecto Stark respectivamente). Además, con ciertas modificaciones semiheurísticas el modelo explica el enlace químico y la estabilidad de las moléculas. Cuando se necesita una alta precisión en los niveles energéticos puede emplearse un modelo similar al de Schrödinger, pero donde el electrón es descrito mediante la ecuación relativista de Dirac en lugar de mediante la ecuación de Schrödinger. El átomo reside en su propio eje. Sin embargo, el nombre de "modelo atómico" de Schrödinger puede llevar a una confusión ya que no explica la estructura completa del átomo. El modelo de Schrödinger explica sólo la estructura electrónica del átomo y su interacción con la estructura electrónica de otros átomos, pero no explica como es el núcleo atómico ni su estabilidad.
Limitaciones
Si bien el modelo de Schrödinger describe adecuadamente la estructura electrónica de los átomos, resulta incompleto en otros aspectos:
1. El modelo de Schrödinger en su formulación original no tiene en cuenta el espín de los electrones, esta deficiencia es corregida por el modelo de Schrödinger-Pauli.
2. El modelo de Schrödinger ignora los efectos relativistas de los electrones rápidos, esta deficiencia es corregida por la ecuación de Dirac que además incorpora la descripción del espín electrónico.
3. El modelo de Schrödinger si bien predice razonablemente bien los niveles energéticos, por sí mismo no explica por qué un electrón en un estado cuántico excitado decae hacia un nivel inferior si existe alguno libre. Esto fue explicado por primera vez por la electrodinámica cuántica y es un efecto de la energía del punto cero del vacío cuántico
El modelo atómico de Dirac Jordan
Nace con una base muy parecida al modelo de Schrödinger. Sin embargo, el modelo de Dirac introduce como novedad la incorporación de manera natural del espín del electrón, así como la revisión y corrección de ciertas teorías relativistas.
El modelo de Dirac Jordan nace de los estudios de Paul Dirac y Pacual Jordan. Tanto en este supuesto como el de Schrödinger, la base tiene que ver con la física cuántica.
Características del modelo atómico de Dirac Jordan
Este modelo utiliza postulados bastante parecidos al conocido modelo de Schrödinger y se puede decir que Paul Dirac fue el que mas aportó a este modelo en particular.
La diferencia entre el modelo de Schrödinger y el modelo de Dirac Jordan es que el punto de inicio del modelo Dirac Jordan utiliza una ecuación relativista para su función de onda.
El mismo Dirac creó esta ecuación y basó el modelo en sus estudios. El modelo de Dirac Jordan tiene la ventaja de que permite concentrar mas orgánicamente o mas naturalmente el espín del electrón. También permite realizar correcciones relativistas bastante apropiadas.
Postulados del modelo Dirac Jordan
En este modelo se asume que cuando las partículas son muy pequeñas, no es posible conocer su velocidad ni su posición de una manera simultánea.
Adicionalmente, en las ecuaciones de dicha teoría, surge el cuarto parámetro con una característica cuántica; este parámetro es llamado número cuántico espín.
Gracias a estos postulados es posible saber dónde se encuentra exactamente un electrón particular, así conocer los niveles de energía de dicho electrón.
Importancia
Estas postulaciones son significativas ya que tienen un aporte en el estudio de las radiaciones, así como también en la energía de ionización. Adicionalmente, son primordiales a la hora de estudiar la energía que libera un átomo durante una reacción.
Ecuación de Dirac
En la física de partículas, la ecuación Dirac es una ecuación de ondas relativistas derivada por el físico británico Paul Dirac en 1928.
En su forma libre o incluyendo interacciones electromagnéticas, describe todas las partículas masivas espín 1/2 como electrones y quarks para las que su paridad es una simetría.
Esta ecuación es una mezcla entre la mecánica cuántica y la relatividad especial. Aunque su creador tenía planes mas modestos para ella, esta ecuación sirve para explicar la antimateria y al espín.
También fue capaz de solucionar el problema de las probabilidades negativas encontradas por otros físicos antes que el.
La ecuación de Dirac es consistente con los principios de mecánica cuántica y con la teoría de la relatividad especial, siendo la primera teoría en considerar completamente la relatividad especial en el contexto de la mecánica cuántica.
Fue validada por considerar los mas especiales detalles del espectro de hidrógeno en una manera completamente rigurosa.
Esta ecuación también implicó la existencia de una nueva forma de materia: la antimateria; previamente insospechada y nunca observada. Años después se confirmaría su existencia.
Adicionalmente, proveyó una justificación teórica a la introducción de distintos componentes en las funciones de ondas en la teoría fenomenológica del espín de Pauli.
Las funciones de onda en la ecuación de Dirac son vectores de cuatro números complejos; dos de los cuales son parecidos a la función de onda de Pauli en el limite no relativo.
Esto contrasta con la ecuación de Schrödinger que describe varias funciones de onda de un solo valor complejo.
Aunque al principio Dirac no entendía la importancia de sus resultados, la explicación detallada del espín como una consecuencia de la unión de la mecánica cuántica y de la relatividad, representa uno de los mayores triunfos de la física teórica.
La importancia de su trabajo es considerado como estar a la par de los estudios de Newton, Maxwell y Einstein.
El propósito de Dirac al crear esta ecuación era explicar el comportamiento relativo de los electrones en movimiento.
De esta manera, se podría permitir al átomo ser tratado de una manera consistente con la relatividad. Su esperanza era que las correcciones introducidas pudieran ayudar a resolver el problema del espectro atómico.
Al final, las implicaciones de sus estudios tuvieron mucho mas impacto en la estructura de la materia y en la introducción de las nuevas clases matemáticas de objetos que en la actualidad son elementos fundamentales de la física.








Muy buena informacion
ResponderEliminarInformación muy considerable gracias
ResponderEliminar